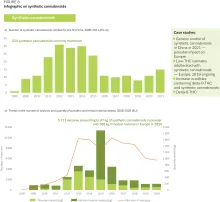
Synthetische Cannabinoide und Spice: Drogenprofil
Synthetische Cannabinoide: Drogenprofil
Synthetische Cannabinoide (korrekte Bezeichnung: Cannabinoid-Rezeptor-Agonisten) ähneln in ihrer Wirkweise Δ9-Tetrahydrocannabinol (THC), dem Wirkstoff in Cannabis. Sie binden sich in gleicher Art und Weise wie THC und der endogene Ligand Anandamid an die Cannabinoid-Rezeptoren im Gehirn und in anderen Organen. Ursprünglich wurden sie in den vergangenen 40 Jahren als therapeutische Mittel zur Schmerzlinderung entwickelt. Es hat sich jedoch als schwierig erwiesen, die gewünschten Eigenschaften von den ungewünschten psychoaktiven Wirkungen zu trennen.
Ende 2008 wurden mehrere Cannabinoide in Rauchmischungen aus Kräutern oder sogenannten Räucherstäbchen/Raumlufterfrischern entdeckt. Typische Beispiele waren Spice Gold, Spice Silver und Yucatan Fire. Später erschienen jedoch noch viele andere Produkte. Sie enthalten weder Tabak noch Cannabis, erzeugen beim Rauchen indessen Wirkungen, die denen von Cannabis ähnlich sind. Diese Produkte werden in der Regel über das Internet und in „Headshops“ verkauft.
Chemie
Obwohl sie oft einfach nur als synthetische Cannabinoide bezeichnet werden, sind viele der Substanzen strukturell nicht mit den sogenannten „klassischen“ Cannabinoiden verwandt — d. h. Verbindungen wie THC auf Dibenzopyranbasis. Die Cannabinoid-Rezeptor-Agonisten bilden eine mannigfaltige Gruppe. Meist handelt es sich dabei um fettlösliche, nicht polare Verbindungen die aus 22 bis 26 Kohlenstoffatomen bestehen, woraus man schließen könnte, dass sie sich beim Rauchen leicht verflüchtigen. Ein gemeinsames strukturelles Merkmal ist eine Seitenkette, die für eine optimale Aktivität mehr als vier und bis zu neun gesättigte Kohlenstoffatome benötigt. Die erste Abbildung zeigt die Struktur von THC, während die anderen Beispiele synthetischer Cannabinoid-Rezeptor-Agonisten zeigen, die allesamt in „Spice“ oder anderen Rauchmischungen gefunden wurden. Die synthetischen Cannabinoide können in sieben Hauptstrukturgruppen untergliedert werden:
- Naphthoylindole (z. B. JWH-018, JWH-073 und JWH-398)
- Naphthylmethylindole
- Naphthoylpyrrole
- Naphthylmethylindene
- Phenylacetylindole (d. h. Benzoylindole, z. B. JWH-250)
- Cyclohexylphenole (z. B. CP 47,497 und Homologe von CP 47,497)
- Klassische Cannabinoide (z. B. HU-210)
Weitere Cannabinoid-Rezeptor-Agonisten sind z. B. Substanzen wie Oleamid — eine endogene Substanz, die auch bei der Kunststoffherstellung verwendet wird — und Methanandamid. Beide sind strukturell mit Anandamid verwandt. Ihre cannabinoide Wirksamkeit ist allerdings fraglich. Es wird vermutet, dass weder Methanandamid noch andere mit Anandamid verwandte Arachidonylderivate ausreichend flüchtig sind, um geraucht werden zu können. Bestimmte Fluorsulfonate weisen eine agonistische Aktivität an cannabinoiden Rezeptoren auf, wie z. B. Naphthalen-1-yl-(4-pentyloxynaphthalen-1-yl)methanon. Letzteres scheint jedoch nicht psychoaktiv zu sein, zumindest nicht bei oraler Verabreichung.
Struktur ausgewählter synthetischer Cannabinoide in „Spice“-Produkten, mit einer hohen Affinität zu cannabinoiden (CB1) Rezeptoren
Molekülstruktur: Δ9-THC
Molekülformel: C21H30O2
Molekulargewicht: 314.4 g/mol

Molekülstruktur: HU-210
Molekülformel: C25H38O3
Molekulargewicht: 386.6 g/mol

Molekülstruktur: CP 47,497
Molekülformel: C21H34O2
Molekulargewicht: 318.5 g/mol

Molekülstruktur: JWH-018
Molekülformel: C24H23NO
Molekulargewicht: 341.5 g/mol

Molecular structure: JWH-250
Molecular formula: C22H25NO2
Molecular weight: 335.4 g/mol

Physische Form
Im Reinzustand liegen diese Stoffe entweder als Feststoffe oder Öle vor. Rauchmischungen werden in der Regel in Päckchen aus Metallfolie verkauft und enthalten typischerweise 3 g getrocknetes pflanzliches Material, dem ein oder mehrere Cannabinoide zugesetzt worden sind. Vermutlich werden die Kräutermischung mit einer Lösung aus Cannabinoiden besprüht. Häufig werden auf der Verpackung viele Pflanzen aufgelistet. Die Mehrzahl davon scheint allerdings nicht darin enthalten zu sein. Nachgewiesen wurden hingegen große Mengen an Tocopherol (Vitamin E) — möglicherweise um die Analyse der aktiven Cannabinoide zu überlagern. Das Vorhandensein unterschiedlicher Cannabinoide in einigen Proben kann auch beabsichtigt sein, um den forensisch-chemischen Nachweis zu stören.
Pharmakologie
Die Cannabinoid-Rezeptor-Agonisten stören die Wirkungen von THC und Anandamid, indem sie mit dem CB1-Rezeptor im Gehirn in Wechselwirkung treten. In vitro-Studien haben gezeigt, dass manche synthetische Verbindungen sich stärker an diesen Rezeptor binden als THC , was über die Messung der Affinitätskonstante Ki festgestellt wurde. Alle in den Rauchmischungen gefundenen Cannabinoide haben wie THC (Ki = 10,2 nM) eine hohe Affinität zu dem CB1-Rezeptor, wenngleich kleine Abweichung in den Ki-Werten der unterschiedlichen Publikationen auftreten. Die Substanz HU-210 hat einen besonders niedrigen Ki-Wert (0,06 nM) und bindet sich über 100 Mal stärker an den CB1-Rezeptor als THC.
Es ist jedoch wenig zur genauen Pharmakologie und Toxikologie der synthetischen Cannabinoide bekannt, und es wurden nur wenige offizielle Humanstudien veröffentlicht. Möglicherweise haben manche Cannabinoide neben ihrer hohen Wirksamkeit besonders lange Halbwertszeiten und führen wohl zu einer verlängerten psychoaktiven Wirkung. Zusätzlich könnten beträchtliche inter- und intraindividuelle Schwankungen in den Rauchmischungen selbst vorliegen, sowohl hinsichtlich der vorhandenen Substanzen als auch deren Menge. Daher besteht eine größere Gefahr einer Überdosis als bei Cannabis.
Synthese und Vorläufersubstanzen
Einige Cannabinoide sind im Handel erhältlich. Für viele andere wurden synthetische Verfahren veröffentlicht, wobei die Drogenausgangsstoffe oftmals im Chemikalieneinzelhandel erwerbbar sind. Die Synthese von Naphthoylindolen aus handelsüblichen Ausgangsmaterialien erfordert jedoch viele einzelne Schritte, wobei die Zubereitung von Dibenzopyranen zusätzlich durch die notwendige Trennung der gewünschten Enantiomere von der racemischen Mischung erschwert wird.
Anwendung
Ebenso wie Cannabis werden die cannabinoidhaltigen Kräutermischungen meist geraucht. Einige Berichte von Konsumenten lassen jedoch vermuten, dass „Spice“ auch gespritzt werden kann.
Andere Namen
Kräuterprodukte, die synthetische Cannabinoide enthalten, sind u. a. Spice Gold, Spice Silver, Spice Diamond, Yucatan Fire, Sence, Chill X, Smoke, Genie, Algerian Blend und viele andere. Diese Produkte können schon überholt sein, da der Internetmarkt sich rasch weiterentwickelt. Die in den Zubereitungen verwendeten synthetischen Cannabinoide werden auch ständig durch „legale“ Alternativen ersetzt, um mit neuen Übewachungsmaßnahmen Schritt zu halten.
Analyse
Cannabinoide lassen sich mittels Gaschromatographie leicht trennen. Ihre Bestimmung und quantitative Analyse ist jedoch durch die Verfügbarkeit von reinen Referenzproben beschränkt. Es sind keine Feldversuche bekannt, welche die Mehrzahl synthetischer Cannabinoide nachweisen. Verfahren für die forensische Analyse von Blutproben zum Nachweis einer kürzlich erfolgten Einnahme synthetischer Cannabinoide stehen in einigen Laboratorien zur Verfügung. Der Nachweis von Metaboliten in Urinproben ist jedoch noch nicht vollständig ausgereift.
Kontrollstatus
Keines der synthetischen Cannabinoide ist einer internationalen Kontrolle durch die Übereinkommen der Vereinten Nationen zur Drogenkontrolle unterworfen, aber JWH-018, JWH-073, HU-210, und CP 47,497 (zusammen mit ihren C6-, C8- und C9-Homologen) sind in einigen Mitgliederstaaten gelistete Drogen.
Die folgenden Länder verbieten „Spice“ und/oder andere synthetische Cannabinoide: Dänemark, Deutschland, Estland, Frankreich, Irland, Italien, Lettland, Litauen, Luxemburg, Österreich, Polen, Rumänien, Schweden und das Vereinigte Königreich.
In Polen sind JWH-018 und einige der deklarierten Bestandteile von „Spice“ kontrollierte Substanzen. In Deutschland überwacht eine Eilverordnung JWH-018 und CP 47,497. In Österreich, Estland und Frankreich sind JWH-018, HU-210 und CP 47,497 gelistete Drogen; zusätzlich zu diesen Drogen wird in Schweden und Litauen JWH-073 als Rauschmittel eingestuft. Luxemburg scheint mit dem Verweis auf „Synthetische Agonisten cannabinoider Rezeptoren“ ein analoges Konzept anzuwenden. Großbritannien hat allgemeine Definitionen angewendet und man erwartet, dass es für einen weiten Bereich synthetischer Cannabinoide Überwachungsmaßnahmen einführen wird. Andere Mitgliedsstaaten erwägen ebenfalls Überwachungsmaßnahmen.
Medizinische Anwendung
Abgesehen von THC (Dronabinol) ist Nabilon, ein Derivat von THC der einzige synthetische Cannabinoid-Rezeptor-Agonist mit klinischer Verwendung und ist Bestandteil des geschützten Präparats Cesamet®. Es findet eine begrenzte Verwendung in der Behandlung von Übelkeit bei der Krebs-Chemotherapie.
Veröffentlichungen
Multimedia und Infografiken
Quellen
Aung, M. M., et al. (2000), ‘Influence of the N-1 alkyl chain length of cannabimimetic indoles upon CB1 and CB2 receptor binding’, Drug and Alcohol Dependence 60, S. 133–140.
Auwärter, V., et al. (2009), ‘Spice and other herbal blends: harmless incense or cannabinoid designer drugs?’, Journal of Mass Spectrometry 44 (5), S. 832–837.
Compton, D. R., et al. (1992), ‘Pharmacological profile of a series of bicyclic cannabinoid analogs: classification as cannabimimetic agents’, Journal of Pharmacology and Experimental Therapeutics 260 (1), S. 201–209.
Compton, D. R., et al. (1993), ‘Cannabinoid structure–activity relationships: correlation of receptor binding and in vivo activities’, Journal of Pharmacology and Experimental Therapeutics 265 (1), S. 218.
Dziadulewicz, E. K., et al. (2007), ‘Naphthalen-1-yl-(4-pentyloxynaphthalen-1-yl)methanone: a potent, orally bioavailable human CB1/CB2 dual agonist with antihyperalgesic properties and restricted central nervous system penetration’, Journal of Medicinal Chemistry 50, S. 3851–3856.
De Vry, J. ynd Jentzsch, K. R. (2004), ‘Discriminative stimulus effects of the structurally novel cannabinoid CB1/ CB2 receptor partial agonist BAY 59-3074 in the rat’, European Journal of Pharmacology 505, S. 127–133.
DEA (US Drugs Enforcement Administration) (2009), Microgram Bulletin (März), 42 (3).
Howlett, A. C., et al. (2002), ‘Classification of cannabinoid receptors’, International Union of Pharmacology XXVII, 54 (2), S. 161–202.
Huffman, J. W. und Duncan, S. G. (1997), ‘Synthesis and pharmacology of the 1’,2’-dimethylheptyl-Δ8-THC isomers: exceptionally potent cannabinoids’, Bioorganic and Medicinal Chemistry Letters 7 (21), S. 2799–2804.
Huffman, J. W., et al. (2003), ‘3-Indolyl-1-naphthylmethanes: new cannabimimetic indoles provide evidence for aromatic stacking interactions with the CB1 cannabinoid receptor’, Bioorganic and Medicinal Chemistry 11, S. 539–549.
Huffman, J. W., et al. (2005), ‘Structure–activity relationships for 1-alkyl-3-(1-naphthoyl)indoles at the cannabinoid CB1 and CB2 receptors: steric and electronic effects of naphthoyl substituents. New highly selective CB2 receptor agonists’, Bioorganic and Medicinal Chemistry 13, S. 89–112.
Huffman, J. W., et al. (2005), ‘1-Pentyl-3-phenylacetylindoles: a new class of cannabimimetic indoles’, Bioorganic and Medicinal Chemistry Letters 15, pp. 4110–4113.
Huffman, J. W. (2009), ‘Cannabimimetic indoles, pyrroles, and indenes: structure–activity relationships and receptor interactions’, in Reggio, P. H. (ed.), The cannabinoid receptors, Humana Press, Totowa, NJ.
Lambert, D. und Di Marzo, V. (1999), ‘The Palmitoylethanolamide and oleamide enigmas: are these two fatty acid amides cannabimimetic?’, Current Medicinal Chemistry 6, S. 757–773.
Lindigkeit, R., et al. (2009), ‘Spice: a never ending story?’, Forensic Science International 191(1-3), S. 58-63.
Mauler, F., et al. (2002), ‘Characterization of the diarylether sulfonylester (-)-(R)-3-(2-Hydroxymethylindanyl-4-oxy)phenyl-4,4,4-trifluoro-1-sulfonate (BAY 38-7271) as a potent cannabinoid receptor agonist with neuroprotective properties’, Journal of Pharmacology and Experimental Therapeutics 302, S. 359–368.
Mechoulam, R. et al. (1988), ‘Enantiomeric cannabinoids: stereospecificity of psychotropic activity’, Experientia 44, S. 762-764.
Pertwee, R. G. (2005), ‘Pharmacological actions of cannabinoids’, in Pertwee, R. (ed.), Cannabinoids, Springer, Berlin.
Piggee, C. (2009), ‘Investigating a not-so-natural high’, Analytical Chemistry 81 (9), S. 3205–3207.
Steup, C. (2008) ‘Untersuchung des Handelsproduktes “Spice”’, 30. Dezember, THC Pharm GmbH.
Uchiyama, N., et al. (2009), ‘Identification of a cannabinoid analog as a new type of designer drug in a herbal product’, Chemical and Pharmaceutical Bulletin 57 (4), S. 439–441.
Uchiyama, N., et al. (2009) ‘Identification of a cannabimimetic indole as a designer drug in a herbal product’, Forensic Toxicology 27, S. 61–66.
Vann, R.E., et al. (2009), ‘Discriminative stimulus properties of Δ9-tetrahydrocannabinol (THC) in C57BL/6J mice’, European Journal of Pharmacology 615 (1-3), S. 102–107.
Weissman, A., et al. (1982), ‘Cannabimimetic activity from CP-47,497, a derivative of 3-phenylcyclohexanol’, Journal of Pharmacology and Experimental Therapeutics 223 (2), pp. 516–23.
Wiley, J. L., et al. (1998), ‘Structure–activity relationships of indole- and pyrrole-derived cannabinoids’, Journal of Pharmacology and Experimental Therapeutics 285 (3), pp. 995–1004.
Zimmermann, U. S., et al. (2009), ‘Withdrawal phenomena and dependence syndrome after the consumption of “Spice Gold”’, Deutsches Aerzteblatt International 106 (27), pp. 464–467.